誉衡生物与艺妙神州将共同推进肿瘤免疫联合治疗
发布时间: 2022-01-27 10:31:19 | 来源: 中国网健康 | 责任编辑: 张丰
1月25日,广州誉衡生物科技有限公司宣布与北京艺妙神州医药科技有限公司就晚期肝细胞癌免疫联合疗法的临床研究及产业化达成战略合作。誉衡生物和艺妙神州将通过共同探索PD-1单抗产品赛帕利单抗注射液(zimberelimab,誉妥®)与IM83 CAR-T(嵌合抗原受体T细胞免疫疗法)联合用药模式,开拓和革新治疗思路和策略,共同推动晚期肝细胞癌免疫治疗的临床研究以及产业化等。此次战略合作将充分发挥双方各自专业领域优势,发挥誉衡生物在肿瘤免疫治疗领域的研发优势和艺妙神州在CAR-T细胞治疗领域的领先技术,合作开发出全新的免疫联合疗法,惠及更多癌症患者。为赛帕利单抗的后续适应症拓展开发奠定基础。
据介绍,肝细胞癌是全球第六大常见癌症,中国肝癌病例约占全球病例的55%,为我国致死率第三位的高发肿瘤。患者数量多、死亡率高、治疗手段有限是我国肝癌防治面临的主要挑战。作为一种PD-1单抗,赛帕利单抗注射液可以与T细胞表达的PD-1受体结合,阻断其与PD-L1和PD-L2之间的相互作用。通过阻断PD-1通路介导的免疫抑制反应,进而激活抗肿瘤免疫反应。CAR-T细胞疗法是通过基因编辑技术使患者T细胞表面能够表达嵌合抗原受体(CAR),将这些表达有CAR的T细胞回输到患者体内,可以特异识别并杀伤肿瘤细胞。尽管这两种方法单独治疗已在多个瘤种中被证明有效,但单药治疗效果在部分瘤种中仍具有一定的局限性,因此免疫治疗联合其他疗法是未来的发展趋势,通过协同效应有效治疗肿瘤,以解决未满足的临床需求。
誉衡生物董事长朱吉满先生表示:“与艺妙神州的合作是公司实现战略发展的关键一步。其自主研发的IM83 CAR-T产品,已被证实能有效杀伤靶点表达阳性的肝癌细胞,在荷肝癌小鼠模型中具有显著且持久的抑瘤效果,并在针对晚期肝细胞癌的探索性临床研究中显示出良好的安全性。希望通过此次合作,将有效推动免疫联合疗法在晚期肝细胞癌治疗上取得重要进展,为患者带来新生希望。”
艺妙神州CEO何霆博士表示:“一直以来,肝细胞癌恶性程度高,患者平均生存期短,可选择的治疗药物有限。通过此次合作将有望解决这一难题,为加快攻克晚期肝细胞癌提供更好的解决方案。”
据了解,赛帕利单抗注射液(誉妥®)是我国第一个使用转基因大鼠平台(OmniRat®)自主研发的全人源抗PD-1单克隆抗体,誉衡生物具有完整的自主知识产权。通过OmniRat®平台研发单克隆抗体,可得到更多高亲和力抗体,最终自然筛选出最优抗体,免疫原性极低,减少了人体针对药物的免疫应答和超敏反应的发生率。赛帕利单抗与PD-1的结合位点位于PD-1的C strand、FG loop和G strand,这与PD-L1/PD-1的结合区域是十分接近的,达到360度全方位阻断PD-1与PD-L1的结合,从而可能具有更好的阻断效力。赛帕利单抗还经过了S228P修饰,在228位用脯氨酸代替丝氨酸,这种突变已被证明能稳定链间二硫键的形成,阻止Fab臂交换,克服了IgG4不稳定性引起的疗效和毒性的不可预测性。
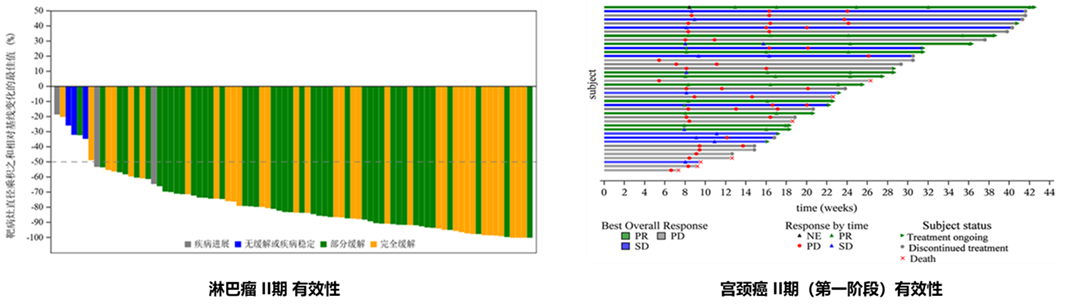
赛帕利单抗于2021年8月25日获批上市,在2020年、2021年连续入选《CSCO淋巴瘤诊疗指南》,并获得专家的II级推荐。在II期临床研究中(数据截止至2021年4月28日),经研究者评估治疗r/r经典型霍奇金淋巴瘤ORR有效率达92.86%,DCR率为96.43%,CR率为34%,12个月PFS率为74%,12个月OS率为99%,且安全性可控。赛帕利单抗治疗晚期实体瘤、淋巴瘤和宫颈癌的多项临床数据曾入选多项国际学术会议,包括ASCO、AACR及ASH。

2021年3月,国家药品监督管理局药品审评中心(CDE)将赛帕利单抗注射液纳入了突破性治疗品种,拟定适应症为接受过一线或以上含铂标准化疗后进展的复发或转移、PD-L1表达阳性(CPS≥1)宫颈癌。2022年1月20日,CDE同意誉衡生物提交赛帕利单抗治疗复发或转移性宫颈癌的上市NDA申请,并同意纳入优先审评审批程序。宫颈癌适应症有望在今年下半年获得批准上市。
誉衡生物成立于2016年,是誉衡药业集团与药明生物在战略合作的基础上成立的一家专注于生物药研发、生产和销售的企业。公司自成立以来获得来自博裕资本、通和毓承、拾玉资本及翼朴资本等的投资。誉衡生物于2017年8月将赛帕利单抗注射液在北美、欧洲、日本等地区的独家开发和商业化权利授权与Arcus Biosciences公司,总合同金额最高可达8.16亿美元。在海外,赛帕利单抗的多项适应症及与TIGIT、CD73和A2aR抑制剂的多项免疫联合疗法正在开展临床研究。在国内誉衡生物也正在积极布局多个适应症和新靶点包括LAG3的研究开发。
